可重复使用医疗器械再处理说明和确认方法 注册审查指导原则(征求意见稿)-I

可重复使用医疗器械再处理说明和确认方法
注册审查指导原则(征求意见稿)
本指导原则旨在指导注册申请人提交可重复使用医疗器械再处理说明和确认方法的申报资料,同时规范可重复使用医疗器械再处理有关内容的技术审评要求。
本指导原则是对可重复使用医疗器械再处理说明和确认方法的一般性要求,注册申请人应根据医疗器械产品特性提交相应的申报资料,判断指导原则中的具体内容是否适用,不适用内容详述理由。注册申请人也可采用其他满足法规要求的替代方法,但应提供详尽的研究资料和验证资料。
本指导原则是在现行法规和标准体系以及当前认知水平下、并参考了国外法规、指南、国内外标准和技术规范等制定的。随着法规和标准的不断完善,以及认知水平和技术能力的不断提高,相关内容也将适时进行修订。
本指导原则是对注册申请人和审评人员的指导性文件,不包括审评审批所涉及的行政事项,亦不作为法规强制执行,应在遵循相关法规的前提下使用本指导原则。医疗机构进行医疗器械的再处理应同时遵守相关部门规定。
一、适用范围
本指导原则适用于可重复使用的医疗器械,主要包括以下两种情形:
(一)最初以无菌形式提供给用户,并且要求用户在首次使用后、后续患者再次使用前,进行再处理(即清洁、消毒或灭菌)的可重复使用医疗器械。
(二)最初以非无菌形式提供给用户,并要求用户进行处理(即清洁、消毒或灭菌)以供首次使用,并在每次使用后进行再处理的可重复使用医疗器械。
仅由单个患者使用,并且预期在每次使用之前需进行再处理的可重复使用医疗器械也适用于本指导原则。以非无菌形式提供,并要求用户在使用前进行处理的一次性使用的医疗器械可参照本指导原则中适用的部分。此外,按照本指导原则中的再处理说明的要求可能不足以杀灭朊病毒,注册申请人应提醒用户按照其他相关规定对预期可能与朊病毒接触的器械进行处理。
本指导原则并未针对某具体的医疗器械提供设计、测试或者再处理确认方面的建议,如有关专用指导原则针对某具体的医疗器械提供了相关建议,注册申请人应遵守专用指导原则。
二、基本原则
(一)可重复使用医疗器械的一般要求
1.设计要求
可重复使用医疗器械的设计应便于用户进行方便和有效的清洁以及必要的消毒或灭菌。一些复杂的器械设计(例如管腔内轴构造、分离器通道、精细通道、密封件和接合关节表面)对清洁和清洁确认提出了特殊要求。在器械的早期设计开发阶段,注册申请人应考虑便于进行有效再处理的设计优化(例如,将难以进行再处理的部件设计为一次性使用、设计冲洗孔、明确和/或提供专用清洁附件等)。
2.确保可重复使用医疗器械的安全性
可重复使用器械的注册申请人和用户在确保医疗器械再处理的安全性和有效性方面都发挥重要作用。注册申请人应充分明确再处理的信息,例如为用户提供再处理应采用的方法、设备、参数等信息。同时注册申请人应根据医疗器械生产质量管理规范的要求,在体系文件中保留相关再处理信息的测试文件、数据、记录等内容,证明再处理的信息已经过确认并易于用户理解且具有可操作性。
(二)再处理说明的一般考虑
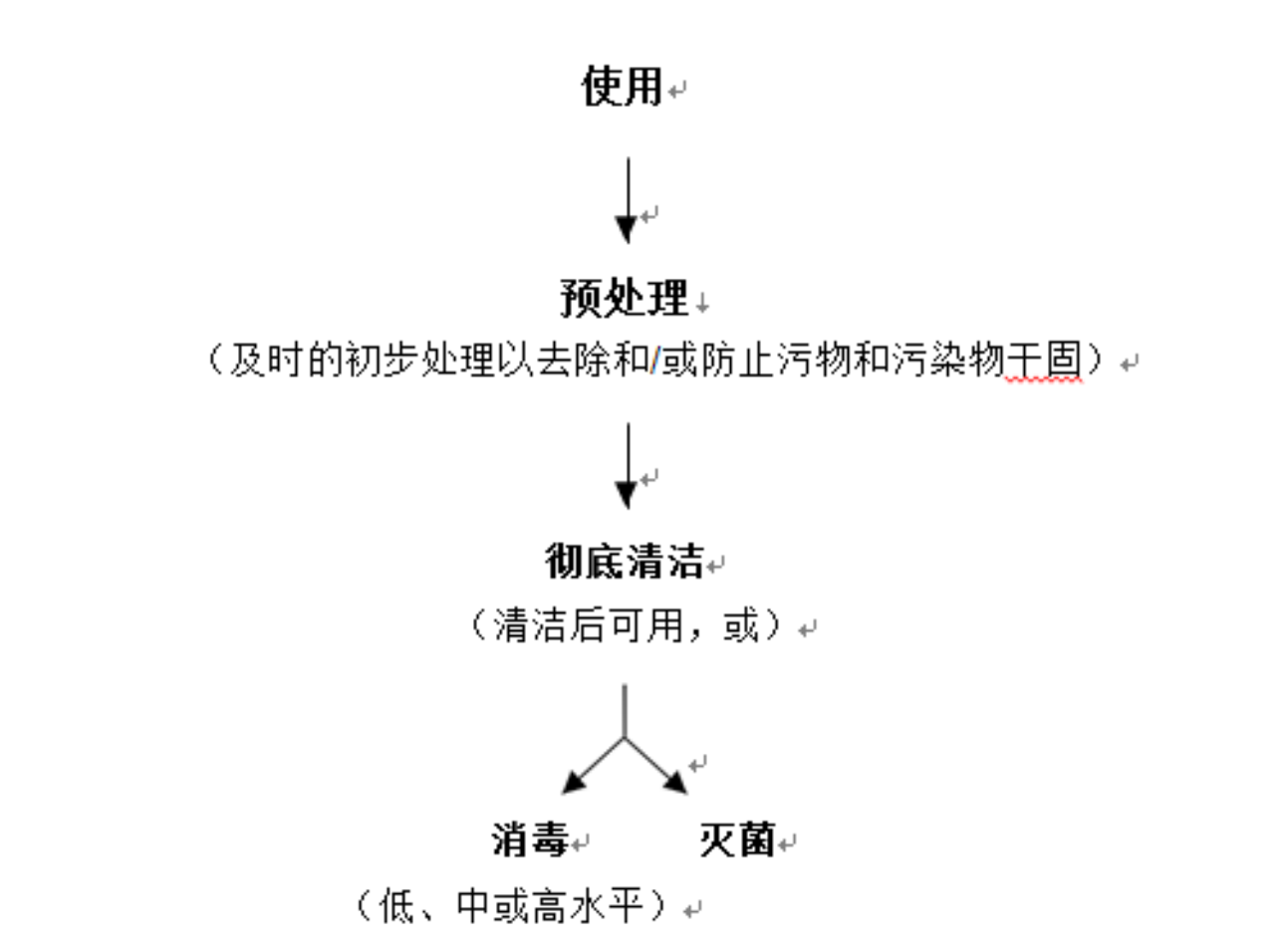
再处理是将使用过的或被污染的医疗器械进行处理以满足后续使用要求的经确认的过程。再处理通常包括清洁、消毒或灭菌,清洁过程用于去除污染,消毒或灭菌用于杀灭微生物。可重复使用器械的再处理从预处理开始,通常包括以下三个步骤:
1.预处理:为了后续更好地清洁,再处理从预处理开始。预处理包含使用后及时的初步清洁步骤或措施,主要目的是防止器械内部和外部的污染物干固。
2.彻底清洁:在预处理后,应彻底清洁器械。通常,应在专用清洁区域进行彻底清洁。在使用期间可能不会被病原体污染的器械(例如血压计袖带、听诊器等)通常不需要消毒或灭菌,因此清洁后即可使用。
3.消毒或灭菌:根据器械的适用范围,器械应进行消毒或灭菌,以供再次使用。
再处理的流程概述如图1所示,附件2中提供了各再处理步骤的详细概述。在某些情形下(如器械被传染病病原体污染),在灭菌处置之前需要对器械进行消毒,这类情形不在本指导原则的考虑范围之内。
需要注意的是,清洁、消毒和灭菌是完全不同的过程。
清洁是通过物理或化学方式去除污物;所采用的清洁方法和医用清洗剂应能有效去除污物。有效的清洁应满足以下几个要求:
最大程度减少污染物在每次使用间的转移;防止残留污物在产品的使用寿命内的积聚;满足后续消毒或灭菌步骤的需要。
消毒和灭菌目的是减少或杀灭微生物,所采用的消毒或灭菌的方法和试剂应能达到相应的消毒或灭菌效果。有关消毒和灭菌的定义,请参考附件1;有关消毒和灭菌过程的具体信息,请参见本指导原则五(五)3的内容。
因此,清洁步骤应独立于消毒或灭菌进行单独确认。
三、清洁过程的确认
对再处理说明中清洁过程进行确认的目的是:该方法(手动或自动)能使器械满足进行下一步处理的要求,并最终可安全重复使用;用户应能正确理解再处理说明中的内容并执行相应的步骤。
(一)应在最不利情况下确认清洁过程
注册申请人应对其再处理说明中的清洁过程进行确认。清洁确认方案的设计应综合考虑产品的预期用途及临床使用时可能受到的污染情况(污染物种类),应包括清洁过程的最不利情况(如清洗最困难,污染最多时的状态等),并至少采用一种与临床污染物有关的定量试验方法。清洁确认方案应明确测试终点,并且能确保该器械最难以清洁的部分通过常规的清洗能够达到预期的清洁效果。对于所有试验,都应选择合理的样本量以证明试验的有效性。
1.人造污染物、接种部位和模拟使用
再处理确认中应包括完整的模拟使用测试方案。
1.1人造污染物
注册申请人应选择一种人造污染物进行测试。人造污染物的成分应能代表其在临床使用时可能接触到的污染物,并且对清洁过程最具挑战性。例如,喉镜在检查时可能会接触血液和粘液,因此,为了模拟最难以清洁的情况,人造试验污染物应为多组分污染物,其中包括模拟血液和粘液的物质。对血液或粘液进行单独的清洁确认不能代表最不利情况下的挑战,因为血液和粘液的混合物更难清洁。所选择的人工试验污染物应对至少一种具有代表性的临床相关污染物成分进行定量试验(例如,总有机碳或蛋白质)。
不建议将孢子(或任何其他微生物)对数减少试验用于确认清洁方法的有效性。关于孢子(或任何其他微生物标记)对数减少值与器械有机物污染去除效果之间的直接相关性,目前还缺少足够的科学证据。微生物的对数减少只能表明再处理过程降低了微生物的数量并不能表明其他有机物污染也降低了。
1.2接种部位
污染物接种应模拟最不利情况的临床使用条件。应在器械上所有可能接触患者材料的部位接种人造污染物,包括所有难以清洁的位置。
1.3模拟使用条件
设计清洁确认方案时,应考虑模拟使用条件,特别是对于因重复使用而导致污染物累积的器械,应采用经历过多次模拟使用后的器械。清洁效果的确认应进行多个完整的使用循环,并用于评估污染物累积情况。模拟使用循环次数应合理。
模拟使用试验过程应与实际使用状态一致,以模拟最不利情况下的临床使用条件(例如,最不利情况持续时间)。为了试验时能充分的对器械进行污染,应对器械所有预期的功能或动作进行操作(如重复连接、弯曲等),对于在临床使用时需通电、加热的器械(如电动牙科手机和高频手术器械),在模拟使用时也应同样模拟这些情况。如果在重复使用过程中会将污物推入器械中更难清洁的部位,则确认的过程应复现这种最不利的情形。如果临床使用后无法立即清洁导致污染物可能干固(例如,没有经过充分处理的外来器械),进行方法确认时应模拟污物干固的最不利情形(最长的时间)。
对照组器械应以与试验组器械完全相同的方式进行制备;阳性对照器械应被污染,阴性对照器械不得污染。
2.确认方案:测试清洁过程的方法
确认方案应明确清洁过程中的时间、温度和浓度等参数。
清洁确认方案应在清洁说明的每个步骤中明确最短时间、最低温度、最低的稀释度等,应能代表所有最不利情况下的再处理条件。且清洁确认方案应将这些最严格的条件用于清洁说明的每个步骤。注册申请人应对再处理说明中的清洁方法和确认方案中的清洁方法进行详细的并行比较,以确定和说明所有最不利情况下的处理条件。
最不利情况再处理条件的示例:
§ 如果清洁说明建议进行10至20分钟预浸泡,确认方案应规定10分钟。
§ 如果清洁说明建议用户在45ºC±5ºC下进行手动清洁,确认方案应规定在40ºC下进行清洁。
§ 酶洗涤剂:一般情况下,“最不利情况”意味着最短时间、最低温度等。但酶洗涤剂例外,其通常具有“最佳有效”的温度范围。确认方案应考虑酶洗涤剂清洁说明中规定的温度范围。
§ 医用清洁器/消毒器:如果清洁过程使用了自动清洁器/清洗消毒器或超声清洁器,则最不利情况应包括自动清洁器/清洗消毒器或超声清洁器的预期循环参数的极限值。
§ 如果器械构成中包含必须在清洁过程中冲洗的管腔、端口或通道,则确认方案应包括最小的冲洗参数,例如时间、冲洗量或流量以及重复次数(例如,10 mL冲洗,执行 3次)。
3.试验:试验类型和方案
3.1选择试验类型
建议至少使用一种能够直接测量有临床意义的相关污染物的定量试验方法。选择试验方法时,应考虑多个因素,包括但不限于:在实际临床使用期间器械预期接触的污染物、临床相关污染物成分的试验特异性,以及试验方法与拟定清洁终点间的灵敏度。
无论选择何种试验类型,在确认过程中都应对器械的外表面和内表面进行目视检查。
注册申请人应提供试验类型的选定理由,可参考国内外相关标准、已发表的文献、已公开的测定方法等。如果注册申请人选择的试验方法与以上内容有差异,应提供相应理由(可参考GB/T 35267、YY/T 0734系列标准等)。
3.2方法确认
注册申请人应对测试污染物残留量的试验方法进行确认。试验方法应包括分析灵敏度和特异性信息,以及拟定的清洁终点,并设置对照组。
建议对照组的设置如下:
阴性器械对照:器械应未污染,并经受与试验器械相同的清洁和提取。残留污染物的量应等于或略高于阴性样本对照。
阳性器械对照:使用已知量的污染物污染器械,但不对其进行清洁,然后提取残留污染物。残留污染物应等于或稍低于所接种的污染物量。在计算时应使用污物回收率校正结果。
阴性样本对照:“提取”应在未使用任何器械的情况下进行。此样本用作空白对照。
阳性样本对照:在未使用任何器械的情况下将已知量的污染物(等于或略高于定量限度)添加到“提取物”中。
3.3提取方法
注册申请人应确认回收器械残留污染物的提取方法,并应确定回收率。确定回收率常使用极限提取和使用已知量的污染物进行提取的方法。提取应对所有表面进行采样,包括内表面(如管腔)和接合表面。在确定回收率试验时,应明确具有最不利情况挑战(最难去除)的被污染部件。应确保用于从器械中去除试验污物的提取量不过大,否则会使用于测定的试验标记物被稀释到检测水平以下。
一些器械的设计会包含在使用过程中可能被污染但在清洁和提取过程中难以接触的较复杂内部结构(例如管腔、内部移动部件)。因此,应设计清洁方法和拆卸方法以接触这些表面。对于此类在结构上较为复杂的器械,在提取方法确认和器械清洁确认中,应对所有相关的内部表面区域进行采样。因此,在确认研究中,可能需要额外的拆卸过程,以便从这些难以接触的区域充分提取残留污染物。这种额外拆卸一般不需要对基本构成组件进行进一步拆解或者破坏产品结构。
对于包含预期不与临床污染物和液体接触的内腔/内部密封结构的器械,应证明清洁液、冲洗水和/或人体的组织、体液等不会通过不完整的密封、接缝或其他内外连通气室渗入器械的内部。
如果确定存在临床污物或清洁液侵入的风险,则应证明清洁方法可满足器械使用期限内任何时候被污染的所有内部表面的清洁终点。