
1. 受理机构:备案人所在地设区的市级市场监督管理局
2. 申请材料清单:
| 材料名称 |
| 1.第一类医疗器械备案表 |
| 2.安全风险分析报告 |
| 3.产品技术要求 |
| 4.产品检验报告 |
| 5.临床评价资料 |
| 6.产品说明书及最小销售单元标签设计样稿 |
| 7.生产制造信息 |
| 8.证明性文件 |
| 9.符合性声明 |
3. 办理基本流程
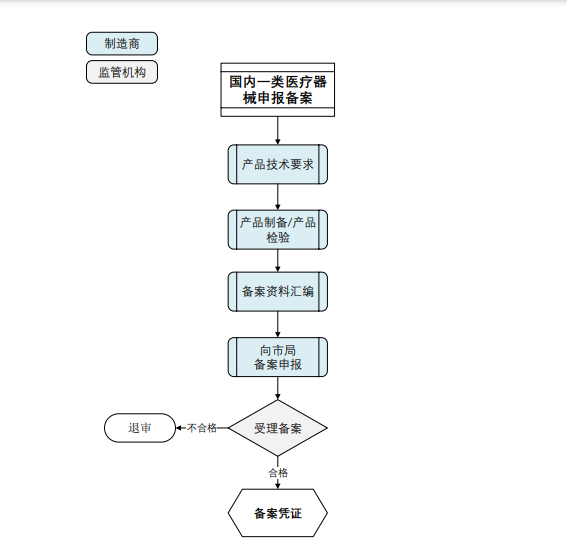
4. NMPA官方收费标准:不收费
5. 检测相关要求有哪些?
| 测试项目 |
| 物理化学性能测试 |
| 生物相容性测试(当产品正常使用过程中与病人有直接或间接接触时) |
| 灭菌确认报告 |
| 货架寿命验证报告 |
| 运输模拟报告 |
熠品临床前研究与检测中心,提供国内I类备案技术咨询、代理及相关检测一站式服务。
欢迎拨打咨询服务热线:021-5473 6833。